基于药效团与GPT从头生成分子,北大开发TransPharmer助力药物发现

编辑 | 萝卜皮
深度生成模型推动了药物发现,但生成的化合物通常结构新颖性有限,限制了药物化学家的灵感。
为了解决这个问题,北京大学的研究人员开发了 TransPharmer,这是一种生成模型,它将基于配体的可解释药效团指纹与基于生成预训练 Transformer(GPT)的框架相结合,用于从头生成分子。
TransPharmer 在无条件分布学习、从头生成和药效团约束下的骨架构建方面表现出色。其独特的探索模式可以增强骨架跳跃,生成结构不同但药理学相关的化合物。这为发现结构新颖且具有生物活性的配体提供了一种有前途的工具。
该研究以「Accelerating discovery of bioactive ligands with pharmacophore-informed generative models」为题,于 2025 年 3 月 10 日发布在《Nature Communications》。

识别具有针对目标生物活性的化合物一直是合理药物发现的重要目标之一。基于深度学习的生成模型已成为当前的主要方法,证明了其在实现这一目标方面的有效性。许多研究人员还专注于通过研究模型组件的多种组合(包括架构、分子表示和优化算法)来探索分子生成模型的潜力。
生成模型虽有效,但其创造力与人类相比如何,能否启发人类专家仍然存疑。实验表明,深度学习模型难以提出符合人类药物化学家认可的分子设计,且自动生成的生物活性化合物的新颖性颇受争议。
科学家通过微调化学语言模型,可以生成与已知化合物高度相似的抑制剂结构。这说明生成模型需深入理解「正确配方」才能生成既具生物活性又新颖的化合物。
药效团模型为增进这一理解提供了替代方法,这类模型通过提取药物作用的关键特征构建分子表征框架,既可促进不同化学骨架配体间的结构跃迁,又能建立分子构效关系的可解释连接。
近期,整合泛药效团特征的生成系统已能设计出保留关键药效特征的新型分子结构,部分模型甚至实现了对现有药物骨架的定向改造,不过大多数基于药效团生成的新分子尚未通过实验验证。
TransPharmer
在最新的研究中,北京大学的研究人员提出了一种创新的药效团感知生成模型 TransPharmer,该模型采用基于配体的药效团核来实现结构抽象,同时保留细粒度的拓扑信息。基于配体的药效团核与之前研究中使用的基于配体的虚拟筛选核类似。
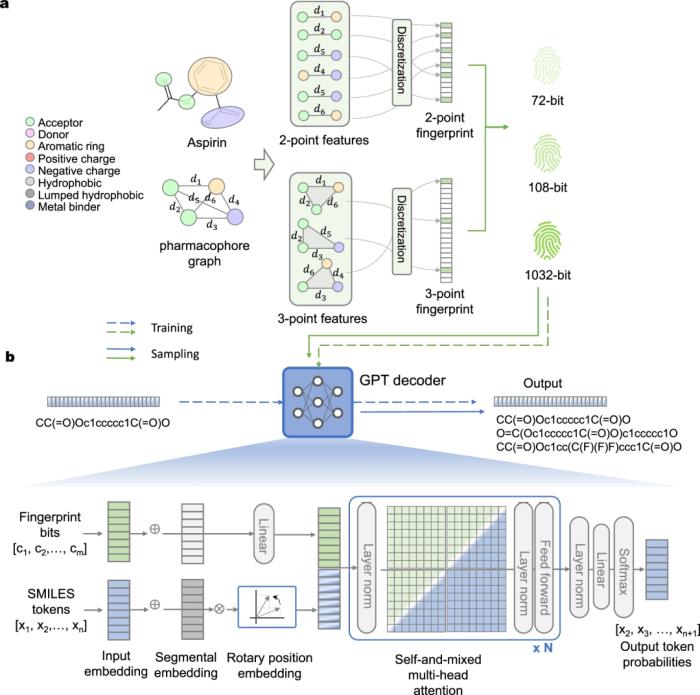
图示:TransPharmer 架构示意图。(来源:论文)
这里的药效团核心被编码为多尺度且可解释的指纹,作为 TransPharmer 的提示。TransPharmer 的架构让人联想到生成式预训练 Transformer(GPT),它在药效团和简化分子输入线输入系统(SMILES)所代表的分子结构之间建立了联系。
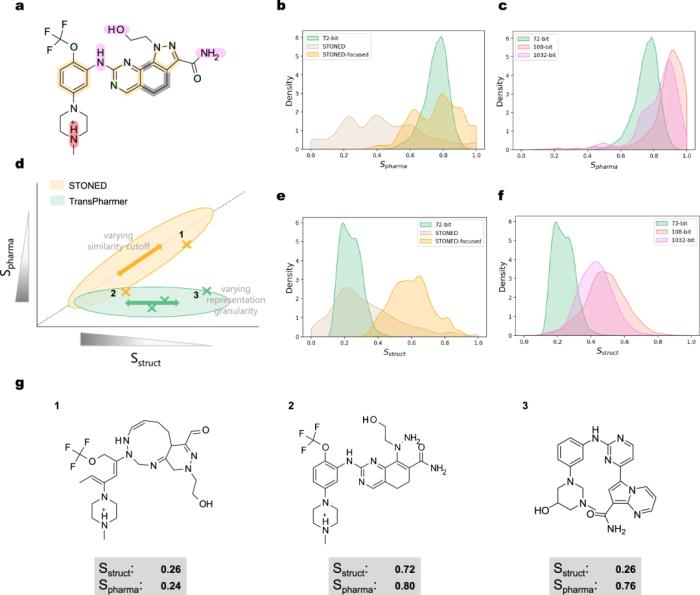
图示:围绕 Onvansertib 的化学空间探索。(来源:论文)
研究人员认为,为 GPT 配备药效团知识可使该模型专注于化学结构的药理方面并生成类药分子。在他们的评估中,TransPharmer 在涉及药效团约束下的从头生成和支架阐述的任务中表现出优于其他基线模型的性能。
该团队还强调了 TransPharmer 在探索参考化合物周围局部化学景观方面的独特模式,使其非常适合药物发现中的骨架跳跃任务。
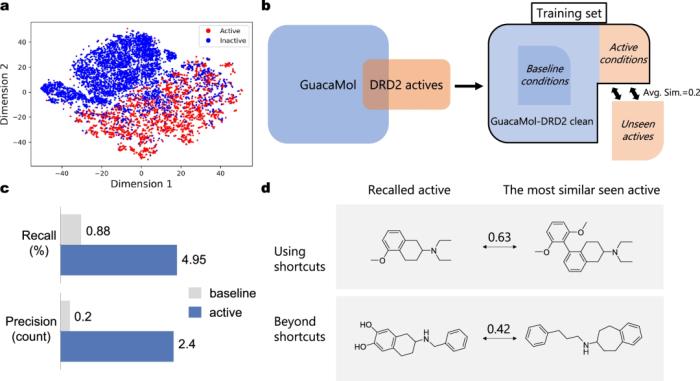
图示:DRD2 的回顾性实验。(来源:论文)
他们通过涉及 DRD2 和 PLK1 的两个案例研究进一步验证了 TransPharmer 产生创新和生物活性配体的能力。研究人员通过实验测试了四种针对 PLK1 的生成化合物,这些化合物具有一系列新骨架。
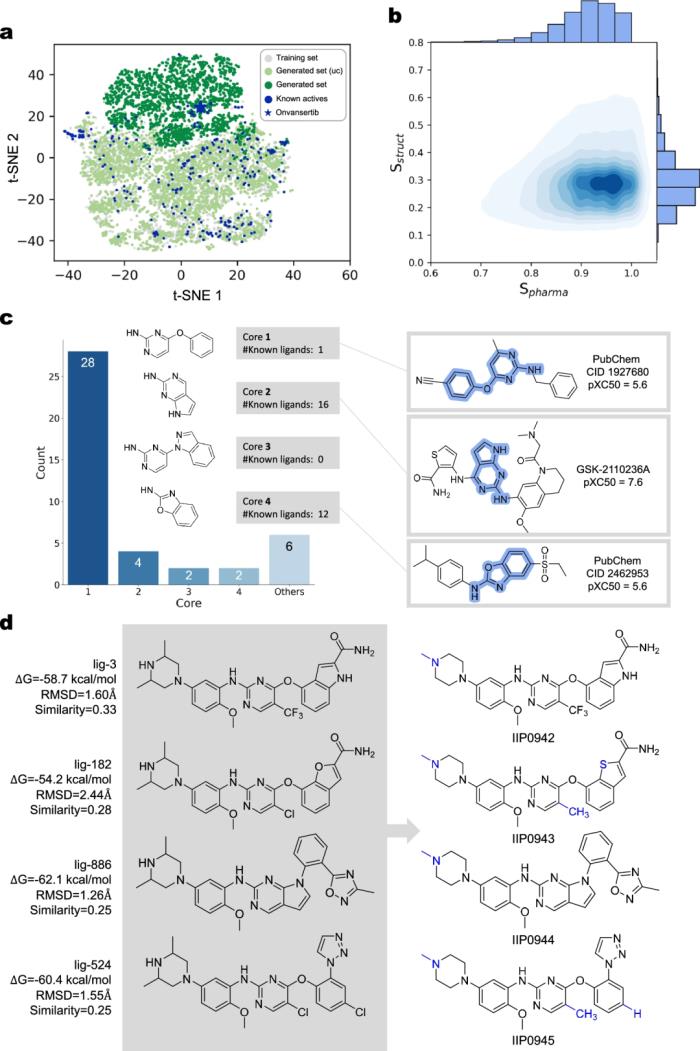
图示:使用 TransPharmer 和化合物优先级生成针对 PLK1 的虚拟化合物库。(来源:论文)
其中,四种化合物中有三种在 1 μM 以下表现出抑制活性,其中最有效的化合物 IIP0943 表现出 5.1 nM 的活性(参考 PLK1 抑制剂为 4.8 nM)。此外,与其他 Plks 相比,IIP0943 对 PLK1 表现出较高的选择性,并且在针对 HCT116 细胞系的细胞增殖中表现出亚微摩尔活性。
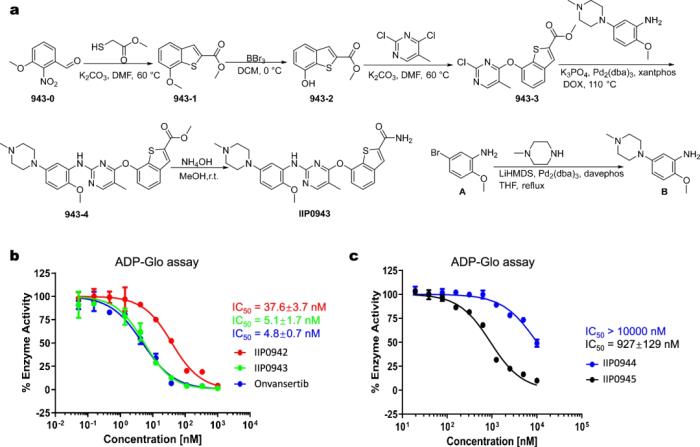
图示:所设计化合物的合成路线及酶抑制活性。(来源:论文)
因此,TransPharmer 代表了一种基于药效团的生成模型,该模型可成功执行骨架跳跃,从而产生具有强效生物活性的独特化合物。IIP0943 的 4-(苯并[b]噻吩-7-基氧)嘧啶骨架可以为设计改进新型 PLK1 抑制剂提供帮助。
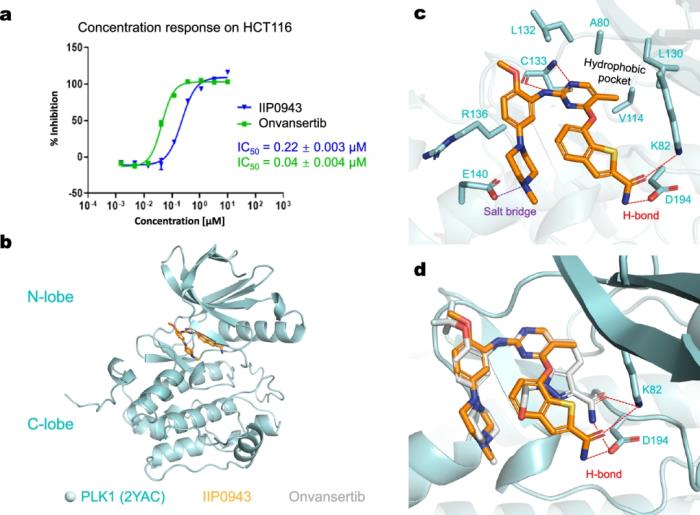
图示:生成的化合物 IIP0943 的细胞抑制活性和对接姿势。(来源:论文)
结语
TransPharmer 中使用的药效团指纹是宝贵的提示,使模型能够在设计不同靶标的配体之间无缝转换,而无需进行额外的微调。DRD2 和 PLK1 的案例研究证明了这一能力,表明 TransPharmer 可轻松应用于各种场景。
与其他基于 GPT 类架构的分子生成模型相比,TransPharmer 通过药效团指纹提示,将先前的知识融入到药物相关化合物的生成中,从而更贴近药物化学家的目标。
这种方法还为开发广泛的药物生成模型铺平了道路,这些模型将多模态知识与从分子结构中得出的基本化学原理相结合。
此外,TransPharmer 利用药效团的结构跳跃特性,可以用于发现针对相同药物靶标具有生物活性的新型化合物。
虽然如此,未来仍可探索几个方向来增强该模型的多功能性和普遍适用性。
第一,应将片段链接等其他生成模式与从头生成和支架构建结合起来。无序化学语言建模的进步可以直接支持这些功能。
第二,生成易于合成的分子的生成模型更可取,因为它们可以加快湿实验室实验验证的时间。
第三,应将多目标优化整合到生成过程中,以支持更高效的设计。
论文链接:https://www.nature.com/articles/s41467-025-56349-0
- 免责声明
- 本文所包含的观点仅代表作者个人看法,不代表新火种的观点。在新火种上获取的所有信息均不应被视为投资建议。新火种对本文可能提及或链接的任何项目不表示认可。 交易和投资涉及高风险,读者在采取与本文内容相关的任何行动之前,请务必进行充分的尽职调查。最终的决策应该基于您自己的独立判断。新火种不对因依赖本文观点而产生的任何金钱损失负任何责任。





 新火种
2025-03-12
新火种
2025-03-12