Nature:机器学习再立功,斯坦福大牛团队实现无创早期肺癌筛查
编者按:本文来自微信公众号“学术头条”(ID:SciTouTiao),作者:学术君,36氪经授权发布。根据 Nature 杂志今天发表的一项研究,斯坦福大学研究人员开发了一种机器学习方法,能够实现早期肺癌患者的鉴别筛查。这一方法基于检测血样中的肿瘤源性 DNA(即液体活检),也就意味着对肺癌高危人群的筛查,做到了早期且无创。传统的肺癌筛查,一般推荐高危群体做 CT 扫描,这种模式已被证明能减少肺癌相关死亡。不过,由于费用高、筛查项目少以及对假阳性的担忧,这种筛查的使用度并不高。即使在美国,也仅有约 5% 符合条件的个体会通过 CT 扫描进行肺癌筛查。而基于液体活检技术的血液检测,是一种当前颇受欢迎的癌症新型检测方法,但大部分液体活检的适用对象,往往是癌症晚期患者,毕竟这些群体的血液中比早期患者拥有更高水平的肿瘤相关 DNA 标记。 在 Nature 今天发表的最新论文中,来自斯坦福大学的 Maximilian Diehn 及其同事,优化了一种现有的评估循环肿瘤 DNA(ctDNA)的测序方法。他们改善了 DNA 的提取,鉴定出有望作为有效疾病标记的变化。研究人员用该方法表明,尽管 ctDNA 在早期肺癌患者体内水平很低,却是一个很有力的预后指标。研究人员随后用这些数据改进了一种机器学习方法,将其用来预测血样中存在的肺癌源性 DNA。在由 104 例早期非小细胞肺癌患者和 56 例匹配对照组成的初期样本中,这种方法可以区分早期肺癌患者与风险匹配的对照;在另一个由 46 例病例和 48 例对照组成的独立验证队列中,研究人员确认了以上结果。备受关注的液体活检近几年,癌症液体活检的表现格外引人关注。作为体外诊断的一个分支,液体活检可以通过非侵入性取样降低检测危害,而且高效准确,性价比高。即使没有进行治疗,癌细胞也会在正常情况下不断分裂和死亡。当癌细胞死亡时,它们将 DNA 碎片释放到血液中,学会阅读这些信息,可以使临床医生快速、无创地监测肿瘤的存在和大小,患者对治疗的反应以及肿瘤面对治疗时随着时间的发展变化。目前,液体活检的检测对象有循环肿瘤细胞(CTCs),循环肿瘤 DNA(ctDNA),循环 RNA(circulating RNA)和外泌体。其中,ctDNA 因研究前景广阔,受到越来越多的关注。ctDNA(circulating tumor DNA)是游离 DNA(cell-free DNA,cfDNA)中的一类,带有特征性标记,可通过高通量测序技术实现对它的定性、定量和追踪。目前已发现的 ctDNA 特征性标记包括位点突变、核小体占有率及甲基化修饰差异,可根据这些指标的差异进行肿瘤的早期诊断、动态监测肿瘤的发生发展及疗效、耐药检测、复发风险评估和预后预测等。美国斯坦福大学 Maximilian Diehn 教授曾表示,ctDNA 不仅可以诊断实体肿瘤,而且能够监测治疗反应以及探查微小残留病灶、靶向治疗耐药突变,可能是优选的无创肿瘤筛查方法。“这一领域令人兴奋的事件之一是,循环肿瘤 DNA 可以应用于许多不同的临床情况。”分子技术与机器学习的结合在这项最新研究中,研究人员介绍了一种通过深度测序 (CAPP-Seq) 来分析循环肿瘤 DNA 的方法,从而更好地实现癌症早期筛查和个性化分析。研究人员发现,尽管早期肺癌的 ctDNA 水平很低,但在大多数患者接受治疗之前,ctDNA 就已经存在,而且它的存在具有很强的预后意义。
在 Nature 今天发表的最新论文中,来自斯坦福大学的 Maximilian Diehn 及其同事,优化了一种现有的评估循环肿瘤 DNA(ctDNA)的测序方法。他们改善了 DNA 的提取,鉴定出有望作为有效疾病标记的变化。研究人员用该方法表明,尽管 ctDNA 在早期肺癌患者体内水平很低,却是一个很有力的预后指标。研究人员随后用这些数据改进了一种机器学习方法,将其用来预测血样中存在的肺癌源性 DNA。在由 104 例早期非小细胞肺癌患者和 56 例匹配对照组成的初期样本中,这种方法可以区分早期肺癌患者与风险匹配的对照;在另一个由 46 例病例和 48 例对照组成的独立验证队列中,研究人员确认了以上结果。备受关注的液体活检近几年,癌症液体活检的表现格外引人关注。作为体外诊断的一个分支,液体活检可以通过非侵入性取样降低检测危害,而且高效准确,性价比高。即使没有进行治疗,癌细胞也会在正常情况下不断分裂和死亡。当癌细胞死亡时,它们将 DNA 碎片释放到血液中,学会阅读这些信息,可以使临床医生快速、无创地监测肿瘤的存在和大小,患者对治疗的反应以及肿瘤面对治疗时随着时间的发展变化。目前,液体活检的检测对象有循环肿瘤细胞(CTCs),循环肿瘤 DNA(ctDNA),循环 RNA(circulating RNA)和外泌体。其中,ctDNA 因研究前景广阔,受到越来越多的关注。ctDNA(circulating tumor DNA)是游离 DNA(cell-free DNA,cfDNA)中的一类,带有特征性标记,可通过高通量测序技术实现对它的定性、定量和追踪。目前已发现的 ctDNA 特征性标记包括位点突变、核小体占有率及甲基化修饰差异,可根据这些指标的差异进行肿瘤的早期诊断、动态监测肿瘤的发生发展及疗效、耐药检测、复发风险评估和预后预测等。美国斯坦福大学 Maximilian Diehn 教授曾表示,ctDNA 不仅可以诊断实体肿瘤,而且能够监测治疗反应以及探查微小残留病灶、靶向治疗耐药突变,可能是优选的无创肿瘤筛查方法。“这一领域令人兴奋的事件之一是,循环肿瘤 DNA 可以应用于许多不同的临床情况。”分子技术与机器学习的结合在这项最新研究中,研究人员介绍了一种通过深度测序 (CAPP-Seq) 来分析循环肿瘤 DNA 的方法,从而更好地实现癌症早期筛查和个性化分析。研究人员发现,尽管早期肺癌的 ctDNA 水平很低,但在大多数患者接受治疗之前,ctDNA 就已经存在,而且它的存在具有很强的预后意义。 Maximilian Diehn 和 Ash Alizadeh 领导的团队进行了本次研究研究人员还发现,肺癌患者游离 DNA (cfDNA) 的大多数体细胞突变,反映的是克隆性造血突变(突变来自于白细胞),并且是非复发性的。与肿瘤衍生突变相比,克隆造血突变发生在较长的 cfDNA 片段上,并且缺乏与吸烟相关的突变特征。将这些发现与其他分子特征结合起来,研究人员开发并前瞻性地验证了一种被称为 “血浆中肺癌可能性”(lung cancer likelihood in plasma, lung - clip) 的机器学习算法,可以很好地将早期肺癌患者与风险匹配对照组区分开来。
Maximilian Diehn 和 Ash Alizadeh 领导的团队进行了本次研究研究人员还发现,肺癌患者游离 DNA (cfDNA) 的大多数体细胞突变,反映的是克隆性造血突变(突变来自于白细胞),并且是非复发性的。与肿瘤衍生突变相比,克隆造血突变发生在较长的 cfDNA 片段上,并且缺乏与吸烟相关的突变特征。将这些发现与其他分子特征结合起来,研究人员开发并前瞻性地验证了一种被称为 “血浆中肺癌可能性”(lung cancer likelihood in plasma, lung - clip) 的机器学习算法,可以很好地将早期肺癌患者与风险匹配对照组区分开来。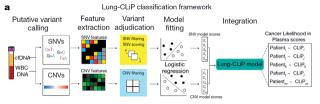 血浆中肺癌可能性 (Lung-CLiP) 的原理图研究人员表示,这种非侵入性的肺癌筛查方法,将改进的分子技术与机器学习相结合,以检测血液样本中肺癌细胞来源的 cfDNA 的存在,可以实现使用血浆检测出相当一部分早期肺癌。而且不同于以往试图开发泛癌种筛查分析的液体活检研究,研究人员这次把重点放在了非小细胞肺癌上,利用肺癌特有的特征,来降低了未被识别的混杂因素对检测结果的影响。此外,不像以前的研究没有进行验证或使用对照队列交叉验证,钙研究使用独立验证,避免了模型过度拟合导致结果过于乐观的可能。研究人员认为,Lung-CLiP 的一个潜在应用是作为一种高风险人群的初步筛查,阳性的患者可以进一步检测确诊,这可能会增加每年进行肺癌筛查的人数,从而拯救更多的生命。论文摘要:
血浆中肺癌可能性 (Lung-CLiP) 的原理图研究人员表示,这种非侵入性的肺癌筛查方法,将改进的分子技术与机器学习相结合,以检测血液样本中肺癌细胞来源的 cfDNA 的存在,可以实现使用血浆检测出相当一部分早期肺癌。而且不同于以往试图开发泛癌种筛查分析的液体活检研究,研究人员这次把重点放在了非小细胞肺癌上,利用肺癌特有的特征,来降低了未被识别的混杂因素对检测结果的影响。此外,不像以前的研究没有进行验证或使用对照队列交叉验证,钙研究使用独立验证,避免了模型过度拟合导致结果过于乐观的可能。研究人员认为,Lung-CLiP 的一个潜在应用是作为一种高风险人群的初步筛查,阳性的患者可以进一步检测确诊,这可能会增加每年进行肺癌筛查的人数,从而拯救更多的生命。论文摘要:
 在 Nature 今天发表的最新论文中,来自斯坦福大学的 Maximilian Diehn 及其同事,优化了一种现有的评估循环肿瘤 DNA(ctDNA)的测序方法。他们改善了 DNA 的提取,鉴定出有望作为有效疾病标记的变化。研究人员用该方法表明,尽管 ctDNA 在早期肺癌患者体内水平很低,却是一个很有力的预后指标。研究人员随后用这些数据改进了一种机器学习方法,将其用来预测血样中存在的肺癌源性 DNA。在由 104 例早期非小细胞肺癌患者和 56 例匹配对照组成的初期样本中,这种方法可以区分早期肺癌患者与风险匹配的对照;在另一个由 46 例病例和 48 例对照组成的独立验证队列中,研究人员确认了以上结果。备受关注的液体活检近几年,癌症液体活检的表现格外引人关注。作为体外诊断的一个分支,液体活检可以通过非侵入性取样降低检测危害,而且高效准确,性价比高。即使没有进行治疗,癌细胞也会在正常情况下不断分裂和死亡。当癌细胞死亡时,它们将 DNA 碎片释放到血液中,学会阅读这些信息,可以使临床医生快速、无创地监测肿瘤的存在和大小,患者对治疗的反应以及肿瘤面对治疗时随着时间的发展变化。目前,液体活检的检测对象有循环肿瘤细胞(CTCs),循环肿瘤 DNA(ctDNA),循环 RNA(circulating RNA)和外泌体。其中,ctDNA 因研究前景广阔,受到越来越多的关注。ctDNA(circulating tumor DNA)是游离 DNA(cell-free DNA,cfDNA)中的一类,带有特征性标记,可通过高通量测序技术实现对它的定性、定量和追踪。目前已发现的 ctDNA 特征性标记包括位点突变、核小体占有率及甲基化修饰差异,可根据这些指标的差异进行肿瘤的早期诊断、动态监测肿瘤的发生发展及疗效、耐药检测、复发风险评估和预后预测等。美国斯坦福大学 Maximilian Diehn 教授曾表示,ctDNA 不仅可以诊断实体肿瘤,而且能够监测治疗反应以及探查微小残留病灶、靶向治疗耐药突变,可能是优选的无创肿瘤筛查方法。“这一领域令人兴奋的事件之一是,循环肿瘤 DNA 可以应用于许多不同的临床情况。”分子技术与机器学习的结合在这项最新研究中,研究人员介绍了一种通过深度测序 (CAPP-Seq) 来分析循环肿瘤 DNA 的方法,从而更好地实现癌症早期筛查和个性化分析。研究人员发现,尽管早期肺癌的 ctDNA 水平很低,但在大多数患者接受治疗之前,ctDNA 就已经存在,而且它的存在具有很强的预后意义。
在 Nature 今天发表的最新论文中,来自斯坦福大学的 Maximilian Diehn 及其同事,优化了一种现有的评估循环肿瘤 DNA(ctDNA)的测序方法。他们改善了 DNA 的提取,鉴定出有望作为有效疾病标记的变化。研究人员用该方法表明,尽管 ctDNA 在早期肺癌患者体内水平很低,却是一个很有力的预后指标。研究人员随后用这些数据改进了一种机器学习方法,将其用来预测血样中存在的肺癌源性 DNA。在由 104 例早期非小细胞肺癌患者和 56 例匹配对照组成的初期样本中,这种方法可以区分早期肺癌患者与风险匹配的对照;在另一个由 46 例病例和 48 例对照组成的独立验证队列中,研究人员确认了以上结果。备受关注的液体活检近几年,癌症液体活检的表现格外引人关注。作为体外诊断的一个分支,液体活检可以通过非侵入性取样降低检测危害,而且高效准确,性价比高。即使没有进行治疗,癌细胞也会在正常情况下不断分裂和死亡。当癌细胞死亡时,它们将 DNA 碎片释放到血液中,学会阅读这些信息,可以使临床医生快速、无创地监测肿瘤的存在和大小,患者对治疗的反应以及肿瘤面对治疗时随着时间的发展变化。目前,液体活检的检测对象有循环肿瘤细胞(CTCs),循环肿瘤 DNA(ctDNA),循环 RNA(circulating RNA)和外泌体。其中,ctDNA 因研究前景广阔,受到越来越多的关注。ctDNA(circulating tumor DNA)是游离 DNA(cell-free DNA,cfDNA)中的一类,带有特征性标记,可通过高通量测序技术实现对它的定性、定量和追踪。目前已发现的 ctDNA 特征性标记包括位点突变、核小体占有率及甲基化修饰差异,可根据这些指标的差异进行肿瘤的早期诊断、动态监测肿瘤的发生发展及疗效、耐药检测、复发风险评估和预后预测等。美国斯坦福大学 Maximilian Diehn 教授曾表示,ctDNA 不仅可以诊断实体肿瘤,而且能够监测治疗反应以及探查微小残留病灶、靶向治疗耐药突变,可能是优选的无创肿瘤筛查方法。“这一领域令人兴奋的事件之一是,循环肿瘤 DNA 可以应用于许多不同的临床情况。”分子技术与机器学习的结合在这项最新研究中,研究人员介绍了一种通过深度测序 (CAPP-Seq) 来分析循环肿瘤 DNA 的方法,从而更好地实现癌症早期筛查和个性化分析。研究人员发现,尽管早期肺癌的 ctDNA 水平很低,但在大多数患者接受治疗之前,ctDNA 就已经存在,而且它的存在具有很强的预后意义。 Maximilian Diehn 和 Ash Alizadeh 领导的团队进行了本次研究研究人员还发现,肺癌患者游离 DNA (cfDNA) 的大多数体细胞突变,反映的是克隆性造血突变(突变来自于白细胞),并且是非复发性的。与肿瘤衍生突变相比,克隆造血突变发生在较长的 cfDNA 片段上,并且缺乏与吸烟相关的突变特征。将这些发现与其他分子特征结合起来,研究人员开发并前瞻性地验证了一种被称为 “血浆中肺癌可能性”(lung cancer likelihood in plasma, lung - clip) 的机器学习算法,可以很好地将早期肺癌患者与风险匹配对照组区分开来。
Maximilian Diehn 和 Ash Alizadeh 领导的团队进行了本次研究研究人员还发现,肺癌患者游离 DNA (cfDNA) 的大多数体细胞突变,反映的是克隆性造血突变(突变来自于白细胞),并且是非复发性的。与肿瘤衍生突变相比,克隆造血突变发生在较长的 cfDNA 片段上,并且缺乏与吸烟相关的突变特征。将这些发现与其他分子特征结合起来,研究人员开发并前瞻性地验证了一种被称为 “血浆中肺癌可能性”(lung cancer likelihood in plasma, lung - clip) 的机器学习算法,可以很好地将早期肺癌患者与风险匹配对照组区分开来。 血浆中肺癌可能性 (Lung-CLiP) 的原理图研究人员表示,这种非侵入性的肺癌筛查方法,将改进的分子技术与机器学习相结合,以检测血液样本中肺癌细胞来源的 cfDNA 的存在,可以实现使用血浆检测出相当一部分早期肺癌。而且不同于以往试图开发泛癌种筛查分析的液体活检研究,研究人员这次把重点放在了非小细胞肺癌上,利用肺癌特有的特征,来降低了未被识别的混杂因素对检测结果的影响。此外,不像以前的研究没有进行验证或使用对照队列交叉验证,钙研究使用独立验证,避免了模型过度拟合导致结果过于乐观的可能。研究人员认为,Lung-CLiP 的一个潜在应用是作为一种高风险人群的初步筛查,阳性的患者可以进一步检测确诊,这可能会增加每年进行肺癌筛查的人数,从而拯救更多的生命。论文摘要:
血浆中肺癌可能性 (Lung-CLiP) 的原理图研究人员表示,这种非侵入性的肺癌筛查方法,将改进的分子技术与机器学习相结合,以检测血液样本中肺癌细胞来源的 cfDNA 的存在,可以实现使用血浆检测出相当一部分早期肺癌。而且不同于以往试图开发泛癌种筛查分析的液体活检研究,研究人员这次把重点放在了非小细胞肺癌上,利用肺癌特有的特征,来降低了未被识别的混杂因素对检测结果的影响。此外,不像以前的研究没有进行验证或使用对照队列交叉验证,钙研究使用独立验证,避免了模型过度拟合导致结果过于乐观的可能。研究人员认为,Lung-CLiP 的一个潜在应用是作为一种高风险人群的初步筛查,阳性的患者可以进一步检测确诊,这可能会增加每年进行肺癌筛查的人数,从而拯救更多的生命。论文摘要:
相关推荐
- 免责声明
- 本文所包含的观点仅代表作者个人看法,不代表新火种的观点。在新火种上获取的所有信息均不应被视为投资建议。新火种对本文可能提及或链接的任何项目不表示认可。 交易和投资涉及高风险,读者在采取与本文内容相关的任何行动之前,请务必进行充分的尽职调查。最终的决策应该基于您自己的独立判断。新火种不对因依赖本文观点而产生的任何金钱损失负任何责任。
热门文章






 新火种
2023-11-13
新火种
2023-11-13