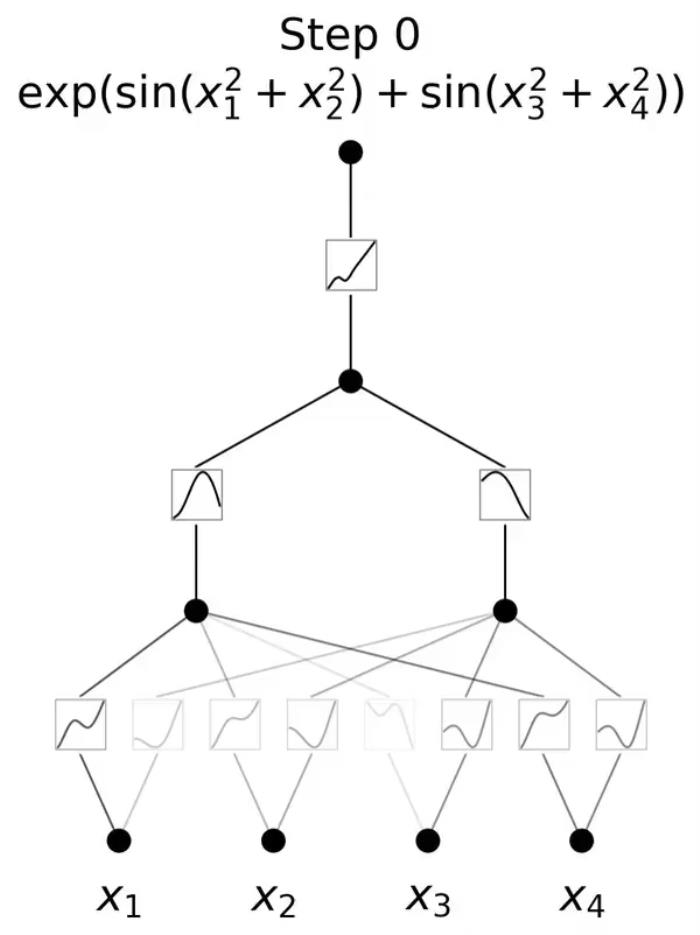
21健讯Daily|29批(台)医械产品抽检不合规;吉利德终止CD47抗体第二项三期临床
这里是《21健讯Daily》,欢迎与21世纪经济报道新健康团队共同关注医药健康行业最新事件!
一、政策动向
●国家药监局:29批(台)医疗器械产品抽检不合规
9月28日,国家药监局发布关于发布国家医疗器械监督抽检结果的通告(2023年第50号)。
为加强医疗器械监督管理,保障医疗器械产品质量安全有效,国家药品监督管理局组织对软性接触镜、超声治疗设备等14个品种进行了产品质量监督抽检,共29批(台)产品不符合标准规定。具体情况通告如下:
一、 被抽检项目不符合标准规定的医疗器械产品
(一) 软性接触镜2批次:DUEBA Contact Lens 杜柏隐形眼镜、Vision Science Co., Ltd. 科尔视株式会社生产,涉及光透过率、后顶焦度不符合标准规定。
(二) 贴敷类医疗器械(远红外治疗贴、磁疗贴、穴位磁疗贴)9批次:沧州前卫医疗用品有限公司、河南天中堂生物科技有限公司、河南万仁药业有限公司、济南康民药业科技有限公司、山东慈恩药业有限公司、郑州市慈安堂医药科技有限公司、郑州添康采药业有限公司、郑州御品堂医疗器械有限公司生产,涉及检出“按照补充检验方法要求不得检出的相关药物成分”。
(三) 血液透析及相关治疗用浓缩物2批次:南京海波医疗器械有限公司、三原富生医疗器械有限公司生产,涉及内毒素限量、微生物限度不符合标准规定。
(四) Nd:YAG激光治疗机1台:Jeisys Medical Inc. 杰希思医疗公司生产,涉及紧急激光终止器、钥匙控制器、标记、激光脉冲持续时间(脉冲宽度)不符合标准规定。
(五) 超声骨密度仪1台:莱福医疗设备有限公司生产,涉及超声声速(SOS)不符合标准规定。
(六) 超声治疗设备2台:天津喜来健医疗器械有限公司、郑州爱博尔医疗设备有限公司生产,涉及输出标记、额定超声输出功率的准确性不符合标准规定。
(七) 电动吸引器1台:辽宁百合医疗设备有限公司生产,涉及人为差错、吸引管道不符合标准规定。
(八) 裂隙灯显微镜2台:C.S.O. SRL 意大利C.S.O.公司、重庆上邦医疗设备有限公司生产,涉及输入功率、显微镜视角放大率允差不符合标准规定。
(九) 生物反馈治疗设备1台:广州市润杰医疗器械有限公司生产,涉及连续漏电流和患者辅助电流(正常工作温度下)不符合标准规定。
(十) 输液泵3台:广东万中科技有限公司、厚爱医疗仪器(江苏)有限公司、郑州路迈医疗科技有限公司生产,涉及指示器、可听报警信号、工作数据的准确性不符合标准规定。
(十一) 压力蒸汽灭菌器1台:宁波开普电子仪表有限公司生产,涉及过流保护不符合标准规定。
(十二) 牙科低压电动马达1台:佛山市驰康医疗器材有限公司生产,涉及漏电流和患者辅助电流(工作温度下)不符合标准规定。
(十三) 胱抑素C测定试剂(盒)1批次:浙江世纪康大医疗科技有限公司生产,涉及准确度不符合标准规定。
(十四) 同型半胱氨酸检测试剂(盒)2批次:安徽同致生物工程股份有限公司、云南昊戌生物科技有限公司生产,涉及准确度不符合标准规定。
以上抽检不符合标准规定具体情况见附件。
二、对抽检中发现的上述不符合标准规定产品,国家药品监督管理局已要求企业所在地省级药品监督管理部门按照《医疗器械监督管理条例》《医疗器械生产监督管理办法》和《医疗器械召回管理办法》等要求,及时作出行政处理决定并向社会公布。省级药品监督管理部门要督促企业对抽检不符合标准规定的产品进行风险评估,根据医疗器械缺陷的严重程度确定召回级别,主动召回产品并公开召回信息;督促企业尽快查明产品不合格原因,制定整改措施并按期整改到位。
二、药械审批
●FDA批准创新眼药水
9月28日,Viatris和Ocuphire Pharma联合宣布,美国FDA已经批准眼药水Ryzumvi(0.75%酚妥拉明眼科溶液)上市,用于治疗由肾上腺素能激动剂或抗副交感神经药物引起的散瞳作用。
眼睛检查、疾病监测或手术过程需要,仅在美国,每年就会进行约一亿次药物介导的散瞳。由药物引起的散瞳在儿童与成人身上可能持续长达24小时。散瞳的副作用包括眼睛对光敏感,视力模糊,给阅读、工作与开车带来困难。
Ryzumvi是一款专有、不含防腐剂的眼药水配方,其中包含了0.75%的酚妥拉明(phentolamine)。通过阻断只有在虹膜扩张肌上表达的α1受体,酚妥拉明能够在不影响睫状肌的情形下调节瞳孔大小(睫状肌是眼睛用以调整看远近物体的肌肉)。Ryzumvi被开发用以逆转药物引起的瞳孔扩大、老花眼以及昏暗视觉障碍(DLD)。
●北海康成罕见病药物在香港地区获批上市
9月28日,北海康成宣布,迈芮倍(氯马昔巴特口服溶液)已在中国香港地区获批上市。氯马昔巴特口服溶液是一种几乎不被吸收的回肠胆汁酸转运蛋白(IBAT)抑制剂,本次在中国香港地区获批治疗3个月及以上阿拉杰里综合征(ALGS)患者胆汁淤积性瘙痒。
ALGS是一种罕见遗传性疾病,可导致末期肝病甚至死亡。ALGS的特点是由于胆管发育异常而引起胆汁淤积,并累及肝外器官,例如肾脏、眼睛、骨骼和心血管系统。胆汁淤积性瘙痒是ALGS中最严重的症状,会大大降低患者生活质量。
●礼来甘精胰岛素注射液在中国获批
9月27日,礼来公司(Eli Lilly and Company)宣布优泌安(甘精胰岛素注射液)正式获得中国国家药品监督管理局(NMPA)批准。该药适用于需用胰岛素治疗的成人1型和2型糖尿病,青少年和年龄在6岁及以上儿童的1型糖尿病。
根据礼来公司介绍,作为基础胰岛素的一员,甘精胰岛素注射液的获批让礼来中国进一步完善了其胰岛素类产品组合。目前,礼来胰岛素家族涵盖了速效、中效、长效及预混胰岛素全线品类。
三、资本市场
●东软熙康成功在香港上市
9月28日,东软熙康控股有限公司 NEUSOFT XIKANG HOLDINGS INC.(以下简称“东软熙康”)(09686.HK),成功在香港联合交易所主板挂牌上市。
东软熙康是中国数字医疗服务市场的先行者之一,是中国首个以城市为入口的云医院平台,并建立了一个云医院网络,将地方政府、医疗机构、患者、保险公司联系起来,以实现公平地获得医疗资源并更有效和高效地交付医疗服务。根据弗若斯特沙利文的报告,截至2023年3月31日,按覆盖的城市数量计算,东软熙康是中国最大的云医院网络。截至2023年3月31日,东软熙康的网络包括中国29个城市的以城市为入口的云医院平台,有2500家医院与公司的云医院网络连接。
●惠每科技宣布完成超3亿元D轮融资
9月26日,医疗人工智能解决方案提供商北京惠每云科技有限公司(简称:惠每科技)宣布完成超3亿元人民币的D轮融资,本轮融资由钟鼎资本领投,润璋创投、苏州宜和等知名投资机构跟投,老股东启明创投继续投资。泰合资本担任本轮融资财务顾问。
四、行业大事
●吉利德终止CD47抗体第二项三期临床
9月27日,吉利德宣布终止CD47抗体Magrolimab治疗携带TP53突变AML患者的三期临床ENHANCE-2。根据分析,吉利德认为Magrolimab相比于标准疗法不可能证明生存获益,因此决定终止。研究中没有发现新的安全性信号。
吉利德Magrolimab一共开展了三项三期临床,目前ENHANCE、ENHANCE-2都已经终止,剩下的一项三期临床ENHANCE-3为联合Venetoclax和阿扎胞苷治疗Unfit AML。ENHANCE终止的解释为基于无效分析,具体原因未说明。ENHANCE-2则更清晰地解释为疗效不足,不可能证明生存获益。
(文章来源:21世纪经济报道)
- 免责声明
- 本文所包含的观点仅代表作者个人看法,不代表新火种的观点。在新火种上获取的所有信息均不应被视为投资建议。新火种对本文可能提及或链接的任何项目不表示认可。 交易和投资涉及高风险,读者在采取与本文内容相关的任何行动之前,请务必进行充分的尽职调查。最终的决策应该基于您自己的独立判断。新火种不对因依赖本文观点而产生的任何金钱损失负任何责任。





 新火种
2023-09-29
新火种
2023-09-29